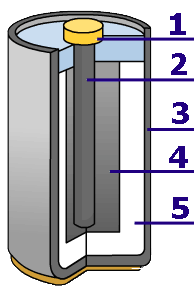
Les piles salines et les piles alcalines sont toutes deux basées sur des électrodes en zinc et en carbone. Comme la composition des électrodes est la même, la tension est également identique: 1.5V. Seul la technologie est différente.
Plus on utilise des éléments séparés dans leur niveau électrique, et plus la tension disponible est élevée. La pile de volta utilisait du cuivre au lieu du zinc et avait une tension de 0.9V. Les piles au lithium ont une tension de 3.6V. Ce métal est tellement réactif que l'électrolyte ne peut pas contenir d'eau.
Les premières piles avaient un électrolyte liquide (même la pile de Leclanché). Plus tard, on a réduit la quantité d'eau au minimum et on a figé l'eau dans un gel: c'est l'apparition des piles dites “sèches” (qui contiennent en fait toujours de l'eau).
La pile de Leclanché ne diffère pas tellement d'une pile sèche: on a simplement gélifié l'électrolyte, et on a éliminé le conteneur en verre (cela faisait très chic à l'époque et cela ne risquait pas d'être attaqué par l'électrolyte). Le conteneur de la pile sèche est maintenant la tige de zinc qui est attaquée quand la pile débite. Le sel utilisé était du chlorure d'ammonium et la tension était de 1.4V. La tension d'un élément est passée à 1.5V quand on a ajouté du chlorure de zinc à l'électrolyte.
Un autre composant important des piles est le dépolarisateur: il va absorber l'hydrogène qui se libère au pole positif (la tige de carbone). L'hydrogène (gaz) est un isolant et empècherait la pile de continuer à fonctionner. La première “pile”, la pile de Volta n'avait pas de dépolarisateur et ne pouvait fournir qu'un courant extrèmement faible.
Pendant la première guerre mondiale, on a fabriqué des piles sans dépolarisateur, en utilisant l'oxygène de l'air pour oxyder l'hydrogène: ce sont les piles Fery dont l'électrode en carbone est creuse pour permettre à l'air d'oxyder l'hydrogène. Le seul dépolarisateur existant devait venir des mines situées en Allemagne.
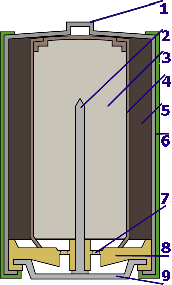
 Les piles salines sont toujours basées sur le principe de la pile de Leclanché (qui est une amélioration très importante de la pile de Volta): une tige de carbone au milieu (2), une solution saline (5) et une électrode extérieure en zinc (3). Le carbone est entouré d'un dépolarisateur (le dioxyde de manganèse en 4) pour capter l'hydrogène qui se libère à la surface du carbone. Le dioxyde de manganèse étant mauvais conducteur, on le mélange à de la poude de carbone. Pendant la décharge, l'électrode en zinc est attaquée, ce qui fait que ces piles peuvent couler quand elles sont vides. On fixe un petit contact métallique (1) sur la tige du carbone pour améliorer le contact électrique.
Les piles salines sont toujours basées sur le principe de la pile de Leclanché (qui est une amélioration très importante de la pile de Volta): une tige de carbone au milieu (2), une solution saline (5) et une électrode extérieure en zinc (3). Le carbone est entouré d'un dépolarisateur (le dioxyde de manganèse en 4) pour capter l'hydrogène qui se libère à la surface du carbone. Le dioxyde de manganèse étant mauvais conducteur, on le mélange à de la poude de carbone. Pendant la décharge, l'électrode en zinc est attaquée, ce qui fait que ces piles peuvent couler quand elles sont vides. On fixe un petit contact métallique (1) sur la tige du carbone pour améliorer le contact électrique.
Le terme "pile saline" provient de l'électrolyte utilisé, une solution concentrée de sel (chlorure d'ammonium et de zinc).
Les piles salines classiques sont utilisées de préférence dans les appareils qui ne consomment pas beaucoup de courant. La tension chute rapidement si un gros consommateur est utilisé, mais la tension remonte entre deux utilisations.
On a fabriqué différents types de piles salines, où on varie le taux de dépolarisateur.
Ce type de pile a souvent été utilisé dans les premiers multimètres (à aiguille) pour la mesure de résistances élevées (plusieurs MΩ). la tension élevée permet d'avoir un courant suffisant pour faire dévier le galvanomètre, mailgré la résistance élevée.
Ces piles peuvent être utilisées dans des situations de détresse (quand il n'y a plus de réseau électrique), sachant que les piles ne perdent pas leur capacité. On utilisera ces piles principalement pour les petits consommateurs (télécommandes, petites lampes et radios, et bien sûr l'éclairage de secours). Elles ne sont pas en mesure de fournir un courant important.
Dans certains cas, les piles classiques sont les seules piles utilisables, car la tension d'1.2V des accus est trop basse pour entrainer les aiguilles d'une horloge. Dans ces applications spécifiques, il faut obligatoirement une tension d'1.5V.
La capacité d'une pile saline de format AA est d'environ 1000mAh. Ces piles sont maintenant remplacées par les piles alcalines graduellement mises sur le marché à partir des années 1960.
Les piles ne pouvant pas fournir suffisamment de courant pour le guidage d'une fusée de type V2 allemande, on a dû utiliser des accumulateurs (à usage unique évidemment...).

Les deux points faibles sont éliminés: la plus grande surface extérieure permet un courant plus important, et le zinc placé au centre peut être consommé totalement. La capacité d'une pile alcaline est ainsi nettement plus importante: environ 2500mAh.
Comme les piles ne fuient théoriquement plus, on a pu remplacer la solution saline par une solution alcaline, meilleure conductrice (réduction de la résistance interne).
Il y a très peu de différences entre les différentes marques en ce qui concerne les piles alcalines (la formulation est identique).
Notez l'existence de piles dites “industrielles” qui sont en fait de simples piles alcalines vendues sans blister. Ce sont exactement les même piles que tu trouves dans le commerce courant, des mesures électriques (courbe de décharge) le prouvent. Ces piles ont une mention "vente dans le commerce de détail interdite", qui sert surtout à différencier ces piles “professionnelles” des piles “amateur”. Le dessin à l'arrière-plan (de la tôle larmée utilisée dans l'industrie lourde) doit accentuer le caractère industriel des piles. Un truc commercial qui a du succès, puisque des utilisateurs signalent que “ces piles fonctionnent bien mieux”, alors qu'il n'y a absolument aucune différence entre ces piles et les piles que tu trouves dans le commerce.
Toutes ces piles (alcalines et surtout salines) ne peuvent pas fournir un courant important (nécessaire dans les appareils photo). L'appareil photo fonctionne un certain nombre de fois et puis se bloque. Les piles ne peuvent pas fournir le courant demandé. Et pourtant, ces piles soit-disant mortes peuvent encore servir un an dans un appareil à faible consommation comme une télécommande.
Il existe également des piles au lithium fournissant une tension de 1.5V et fabriquées dans le même format que les piles zinc-carbone. Elles utilisent un petit convertisseur pour transformer la tension de 3.7V vers 1.5V, tout comme le Batterijser (voir plus bas).
Le tableau à droite en provenance de Wonder indique la capacité d'une pile de format AA R6 en formulation alcaline et saline. Les consommations correspondent à un jouet à moteur électrique, une lampe DEL pour vélo, une petite radio utilisée à basse puissance. La consommation de 5mA ne correspond à rien en particulier (une horloge consomme environ 100µA).
Ce tableau nous apprend les choses suivantes:
Le batteriser est un petit circuit qui se clipse sur les piles et qui contient un convertisseur qui augmente si nécessaire la tension jusqu'à 1.5V. Ce n'est pas une nouvelle technologie, la nouveauté réside dans la miniaturisation des composants, permettant de faire un convertisseur qui ne prend pratiquement pas de place. Ce circuit peut travailler jusqu'à une tension de pile de 0.6V. Pour être effectif, il faut évidemment un circuit par pile dans les appareils utilisant plusiers éléments.
Ce circuit est évidemment plus interessant pour certains accessoires (souris sans fil) que pour d'autres (lampe torche). Une lampe torche (lampe à incandescence) peut fonctionner avec une pile relativement vide: la lumière est simplement un peu moins blanche.
Le zinc est donc oxidé plus rapidement que d'autres métaux et les protège ainsi de l'oxidation. Le zinc est ainsi utilisé pour protéger des structures en fer. Cette protection qu'on appelle protection cathodique utilise une électrode sacrificielle qui est rongée petit à petit. Quand la masse est réduite à 10% de la masse originelle, il faut remplacer l'électrode. Les trois images montrent l'usure de l'électrode.
La protection cathodique est utilisée pour des navires (pour réduire l'oxydation de la coque en métal (généralement de l'acier, donc une composition contenant du fer), les pipe-lines, les réservoirs, les plateformes de forage, etc. Même les monuments en métal peuvent ainsi être protégés.
Les installations en cuivre peuvent être protégées par une électrode en fer (le fer est moins cher que le zinc). Quand il faut protéger du zinc, il faut utiliser un métal encore plus électropositif comme l'aluminium ou même le magnésium. On utilise également ces métaux quand la conductivité électrique est faible (eau douce, terrains secs, etc).
La protection cathodique des navires par des électrodes en zinc est particulièrement importante près des hélices qui sont en bronze ou laiton qui sont plus nobles que le fer, et qui produisent donc une corrosion accrue de la coque en acier. Le fer agit en somme comme protection cathodique du bronze: l'hélice ne va jamais se corroder, mais bien la coque.
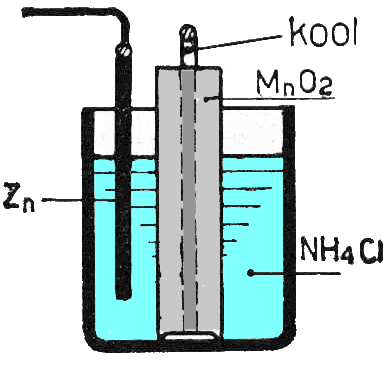
Pile Leclanché






-