Lithium batterijen zijn tegenwoordig de meest gebruikte batterijen. Ze bestaan zowel in niet-oplaadbare als in oplaadbare vorm. Er zijn verschillende technologiën die allemaal een verschillende spanning leveren.
Lithium is één van de meest electropositieve metalen. Daardoor kan dit metaal de hoogste spanning leveren: één lithium cel geeft een even hoge spanning als drie NiMH cellen. Maar dit betekent ook dat lithium één van de gevaarlijste stoffen in om in batterijen en accus te gebruiken.
Lithium is één van de lichtste metalen en is dus ideaal in mobiele toepassingen: smartphones en batterijen voor electrische fietsen en auto's. Het lithium atoom is klein en daardoor heel mobiel. In de batterijen beweegt het lithium van de ene electrode naar de andere bij het laden en ontladen.
Lithium niet-oplaadbare batterijen (primaire batterijen)
Het onderzoek naar lithium als batterij-grondstof is al lang aan de gang. De knoopcellen bestaan al sinds de jaren '80. Deze cellen leveren een hoge spanning (tussen 3 en 3.6V), hebben een lange levensduur en een hoge capaciteit.Lithium (metaal) mag niet in contact komen met water: die zou een ontleding van water veroorzaken met de produktie van waterstofgas. Daarom gebruikt men geen waterige electrolieten bij lithium cellen. Op de afbeelding is het electroliet niet op basis van water, maar het is een organische stof die niet met lithium reageert.
Het is mogelijk lithium batterijen op te laden, maar lithium is uiters reaktief en kan vuur vatten als de lading niet correct verloopt. De cel mag niet teveel opwarmen, mag niet te snel opladen, de spanning mag niet teveel stijgen, enz. Cellen op basis van lithium-metaal zijn te gevaarlijk om opnieuw op te laden (terwijl dit chemisch heel goed mogelijk is).
Lithium-ion accus
Door het lithium metaal te binden kan men toch oplaadbare cellen maken. In deze cellen bestaat het lithium enkel onder de vorm van een ion (vaandaar de juiste naam: lithium-ion). Bij het laden en ontladen gaan de lithium-ionen van de ene electrode naar de andere, terwijl er een identieke electronenstroom van de ene pool naar de andere gaat (externe electrische kring).Door het lithium te binden aan een ander materiaal verliest men natuurlijk capaciteit, aangezien de hoeveelheid lithium (het component dat voor de capaciteit van de accu zorgt) lager is. De capaciteit van een lithium-metaal batterij (niet oplaadbaar is 3000mAh (AA-formaat), terwijl de capaciteit van een accu gaat van 400 tot 800mAh (naargelang de technologie). Het is enkel omdat de lithium batterijen een hogere klemspanning hebben en licht zijn, dat ze gebruikt worden, want de energie die in een cel opgeslagen wordt is vergelijkbaar met die van een NiMH batterij.
Lithium AA: 3.7V × 700mAh = 2.6Wh
NiMH AA: 1.2V × 2000mAh = 2.4Wh
Omdat er geen waterige electroliet gebruikt wordt is de wet van Peukert niet van toepassing en hebben de batterijen een hoog rendement, ongeacht de stroom. Als de batterij ouder wordt stijgt echter zijn inwendige weerstand, waardoor een soortgelijk fenomeen las de wet van peukert kan optreden.
Samenstelling van lithium-ion oplaadbare batterijen
De twee electroden bestaan uit grafiet aan de ene pool en een metaalverbinding (zoals cobaltoxide, mangaanoxide, ijzerfosfaat,...) aan de andere pool. De electroden hebben een zodanige struktuur dat ze gemakkelijk lithium metaal kunnen opnemen. Grafiet is zwart van kleur, maar wordt goudkleurig als die lithium opgenomen heeft.Het electroliet laat de lithium ionen gemakkelijk door, maar is een electrische isolator (in tegenstelling met andere accus met een electroliet op waterbasis). De electrische stroom bestaat uit lithium-ionen in de accu en electronen in het circuit buiten de accu.
Eigenschappen van lithium-ion oplaadbare batterijen
Lithium-ion accus hebben een spanning van 3.6 à 3.7V. Bij de lading mag de spanning de 4.2V niet overschrijden, en de cellen mogen niet ontladen worden onder de 2.5V (we hebben het hier over de meest courante types lithium-ion accus op basis van cobalt en/of mangaan).Hoe verder men een accu oplaadt, hoe minder cyclussen dat de cel kan uitvoeren. Bij het laden wordt het raster dat het lithium moet opnemen langzamerhand beschadigd, waardoor de opname van lithium-ionen minder goed verloopt. Indien men de batterij slechts tot 4.1V oplaadt, dan heeft men 90% van de nominale capaciteit, maar gaat de accu tweemaal zoveel cycli mee.
De accu te ver ontladen is ook niet goed (spanning onder de 2.5V). De cellen worden gefgabriceerd in ongeladen toestand en dan in de fabriek opgeladen in de fabriek. Een accu die volledig leeg is geraakt, moet heel langzaam weer opgeladen worden (laadstroom minder dan 0.1C). Bij oudere batterijtypes is een volledige ontlading schadelijk.
Waarom worden de accus dan uitgeschakeld door het BMS (Battery Management System) als hun spanning onder de 2.5V komt?
De reden is eenvoudig, en een begin van uitleg werd reeds gegeven: de lading moet zeer traag gebeuren tot de spanning weer boven de 3V komt. Indien men de batterij direct met de nominale laadstroom zou opladen, dan gaat de accu stuk. De accu kan zelfs vuur vatten.
Zelfs de batterijladers die iedere cel individueel laden hebben meestal geen stroombeperking als de cel volledig leeg is. Dergelijke laders werken enkel in CC/CV modus (Constant Current/Constant Voltage). In een batterijpack zitten er meerdere cellen in serie, en bij het laden zal de volledig lege cel zich veel te snel opladen. De totale spanning van het pack blijft echter laag omdat alle cellen redelijk ontladen zijn zodat de veiligheid van de lader niet werkt.
Het is om dergelijke situaties die gevaarlijk kunnen zijn te vermijden dat de accubewaking cellen die onder de 2.5V komen uitschakelt.
Lithium-ion accus bewaren
Natrium in plaats van lithium

Er is ook onderzoek gaande met kalium-accus (ook een metaal uit dezelfde groep van alkali-metalen). Beide metalen zijn gemakkelijker te gebruiken dan lithium. Er is ook onderzoek naar magnesium: dit element is tweewaardig en levert dus twee electronen per atoom in plaats van één voor lithium, natrium en kalium.
Niet-oplaadbaar en wel oplaadbaar
Primaire of secundaire batterijen
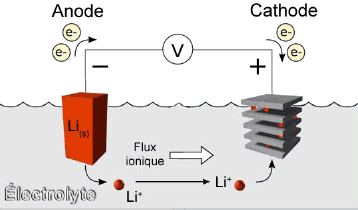
Primaire cel met lithium (metaal)
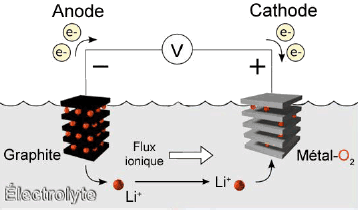
Lithium-ion accu
Het metaal is gebonden en de cel is veiliger in het gebruik
Als men zonneënergie en windenergie in batterijen zal opslaan, dan zal men een andere technologie dan de lithium-accu moeten gebruiken, want lithium is een zeldzaam metaal. Er is gewoon te weinig lithium op aarde aanwezig om voldoende batterijen te maken. Natrium daartegenover kan gehaald worden uit zeewater. Er wordt geen onderzoek meer gedaan naar lithiumbatterijen voor de opslag van energie, want wetenschappers weten dat de prijs van de batterijen zal stijgen omdat er gewoon te weinig lithium aanwezig is op aarde.
Omdat het natrium-atoom groter is dan het lithium atoom gebeurt de verplaatsing van de natrium-ionen minder gemakkelijk. Het electroliet is geen vloeistof maar een vaste stof en de ionen moeten tussen de mazen van het net bewegen. Bij de eerste ontwerpen was het aantal cycli eerder teleurstellend, maar tegenwoordig haalt men tot 2000 laadcycli. In tegenstelling met lithium-batterijen die niet volledig ontladen mogen worden (er moet 30% restcapaciteit in de cel blijven om zeker te zijn dat de cellen uit een pack correct opgeladen worden) kunnen de natrium batterijen volledig ontladen worden.
De natrium-batterijen zijn nog het meest vergelijkbaar met de lithium-ijzer-fosfaat (LFP) batterijen: heel veilig en gemiddelde capaciteit. Er bestaat al een prototype van de batterij in 18650-formaat.