Niet-oplaadbare batterijen (primaire batterijen) bestaan nog altijd. Zij hebben als voordeel dat ze hun lading nauwelijks verliezen en dus altijd "klaar voor gebruik" zijn. Ze hebben echter een lagere capaciteit en kunnen minder stroom leveren dan oplaadbare batterijen. Bij het gebruik in een flitser zal de flitser veel trager opladen, gebruikt in een fototoestel zal het apparaat vroegtijdig uitschakelen omdat de batterijen onvoldoende stroom kunnen leveren. De batterijen zijn echter nog goed en kunnen bijvoorbeeld in een afstandsbediening gebruikt worden.

| De klassieke zink-koolstof batterijen bestaan nog steeds! |
|---|
Gewone batterijen (in plaats van oplaadbare batterijen) zijn ideaal in toestellen die weinig stroom trekken: afstandsbedieningen, klokjes, kleine lampjes. In sommige gevallen is de lage klemspanning van een NiMH accu (1.2V in plaats van 1.5V) te weinig om de wijzers van een klok aan te drijven.
Scheikunde
De andere electrode bestaat meestal uit een koolstaaf. Bij de ontlading wordt hier waterstof geproduceerd, en die moet absoluut gebonden worden (waterstofgas is een isolator!) Om het waterstofgas te binden gebruikt men mangaandioxide die gemengd is met koolstofpoeder rond de koolstofstaaf.
Er is heel veel mangaandioxide nodig, en tijdens de eerste wereldoorlog gebruikte men batterijen zonder depolarisator (mangaandioxide kon toen enkel gewonnen worden in enkele duitse mijnen). De koolstofstaaf was redelijk dik en in het midden doorboord zodat zuurstof in de staaf kon dringen en zich aan het waterstof binden (Fery batterij, zie afbeelding rechts). Deze batterij had weinig onderhoud nodig: als de zinken plaat op de bodem opgevreten was, moest die gewoon vervangen worden. Het electroliet werd dan ook vervangen (zoutoplossing). De batterij kon slechts een beperkte stroom leveren (rekening houdend met zijn afmetingen), maar dit was de enige batterij die vlot in deze crisisperiode beschikbaar was.
Leclanché-cel
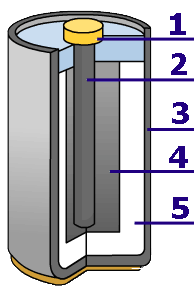 Primaire batterijen bestaan er in verschillende uitvoeringen: de klassieke batterij die op het principe van de Leclanché-cel gebaseerd is: een koolstaaf binnenin (2), een zoutoplossing (5), vandaar de naam: saline batterij en een zinken omhulsel (3). De batterijen hebben ook een laag mangaandioxide als depolarisator rond de koolstofstaaf om het waterstofgas op te vangen (4). 1 is een metalen kap om de stroom af te nemen aan de koolstaaf. Bij de reaktie wordt het zinken omhulsel opgevreten, en daarom kunnen deze batterijen uitlopen als ze leeg zijn. De capaciteit van een AA-batterij is ongeveer 1000mAh. Saline-batterijen worden nog steeds gefabriceerd: dat zijn de batterijen die in bulk verkocht worden, vaak onder de naam van de distributieketen.
Primaire batterijen bestaan er in verschillende uitvoeringen: de klassieke batterij die op het principe van de Leclanché-cel gebaseerd is: een koolstaaf binnenin (2), een zoutoplossing (5), vandaar de naam: saline batterij en een zinken omhulsel (3). De batterijen hebben ook een laag mangaandioxide als depolarisator rond de koolstofstaaf om het waterstofgas op te vangen (4). 1 is een metalen kap om de stroom af te nemen aan de koolstaaf. Bij de reaktie wordt het zinken omhulsel opgevreten, en daarom kunnen deze batterijen uitlopen als ze leeg zijn. De capaciteit van een AA-batterij is ongeveer 1000mAh. Saline-batterijen worden nog steeds gefabriceerd: dat zijn de batterijen die in bulk verkocht worden, vaak onder de naam van de distributieketen.
Deze batterijen worden "droog" genoemd, hoewel dit niet helemaal waar is (enkel lithium batterijen kunnen als "droog" bestempeld worden!). De zoutoplossing is zo geconcentreerd en met een gel vermengd, dat het electroliet een pasta vormt. Men gebruikt de naam droog om het verschil te maken met de eerste batterijen die vloeistoffen bevatten en rechtop gebruikt moesten worden (de eerste Leclanché cellen waren trouwens natte batterijen).
Heavy duty
Mangaandioxyde is een slechte geleider, daarom hebben deze batterijen een ralatief hoge inwendige weerstand. Bij toepassingen waar een hoge stroom nodig is wordt er minder mangaandioxyde gebruikt (met een verminderde capaciteit als gevolg). Ook wordt de hoeveelheid zinkchloride verder verhoogd. Deze batterijen werden gebruikt voor de komst van de alkaline batterijen daar waar een hoge stroom nodig was (Heavy Duty).Zelfs de Heavy Duty batterijen waren niet in staat om een voldoende hoge stroom te leveren voor de sturing van de V2-raketten tijdens de tweede wereldoorlog. De duitsers hebben daarom loodaccus moeten gebruiken (startbatterijen). Deze accus werden natuurlijk slects éénmaal gebruikt!
Photoflash
Photoflash batterijen moeten een relatief hoge spanning kunnen leveren om de magnesiumdraad van de toen gebruikte flitsers te doen ontbranden. In deze batterijen zitten 15 kleine knoopcellen. Deze batterijen hadden een werkspanning van 22.5V (met een zeer lage stroomsterkte vanwege de serieschakeling van talrijke knoopcellen).Bij flits-toepassingen werd er een condensator over de batterij gemonteerd: in rust werd de condensator opgeladen tot de nominale batterijspanning. Bij het flitsen diende de condensator voor de nodige energievoorziening (25mW).
Deze batterijen werden vaak gebruikt in de eerste multimeters (met naald) voor het MΩ-bereik. Door de relatief hoge spanning kon er toch een voldoende stroom door de weerstand lopen om de meter te doen uitslaan.
De Aquacell batterij (een saline zink-koolstof batterij) wordt op een nieuwe pagina besproken.
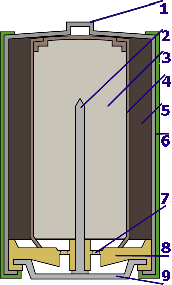
Alkaline batterijen
- Stalen contact
- Zinkstaaf
- Kalium hydroxide en zinkpoeder
- Scheiding
- Mangaandioxide en koolstofpoeder
- Plastiken behuizing
- Ventiel
- Centreerstuk
- Electrisch contact
Bij de alkaline-batterij zijn de elektroden van plaats gewisseld: met de zinken staaf in het midden en de koolstofelectrode aan de buitenkant. De batterij heeft een stalen buitenmantel.
Beide zwakke punten van de klassieke batterij worden geëlimineerd: het zink dat ook als omhulsel diende zit nu vanbinnen en het kan geen kwaad als die volledig opgevreten wordt. De koolstofstaaf met mangaanoxyde (het element met de hoogste ohmse weerstand en dus verlies) zit nu aan de buitenkant waar de aktieve oppervlakte veel groter is. Omdat de batterij (theoretisch) niet lekt kan de zoutoplossing vervangen worden door een sterkere loog (vandaar de naam alkaline batterij).
In tegenstelling met zoutbatterijen (saline batterij) zijn er nauwelijks verschillen in samenstelling tussen de verschillende merken. De capaciteit bedraagt 2500mAu ongeacht het merk. Alkaline batterijen kunnen beperkt opnieuw opgeladen worden.
Hoewel de alkaline batterijen een hogere stroom kunnen leveren is dit nog steeds niet genoeg voor grote verbruikers zoals flitsers en digitale fototoestellen. Enkel oplaadbare batterijen (of de lithium-ijzer disulfide batterien) kunnen een stroom leveren die hoog genoeg is.
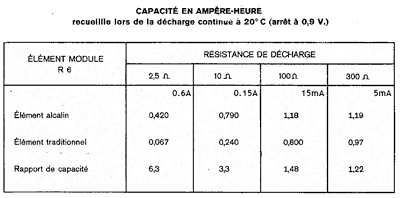
De tabel rechts afkomstig van de franse fabrikant Wonder toont ons hoeveel stroom een batterij van het type AA/R6 kan leveren naargelang de belasting. Een belasting van 0.6A komt overeen met electrisch speelgoed met motor, 150mA met een LED fietslamp, 15mA met een kleine radio die stil speelt en 5mA komt met niets specifieks overeen (een wandklok verbruikt ongeveer 100µA).
De tabel leert ons het volgende:
- Bij laag verbruik is er nauwelijks een verschil tussen saline en alcaline batterijen. Dit is ook normaal, de beide batterijen bevatten ongeveer dezelfde hoeveelheid aktief materiaal (zink en mangaandioxyde). Moderne alkalines zijn verder ontwikkeld geweest en hebben nu wel een hogere capaciteit.
- Bij een hoog verbruik is de saline batterij uitgeput terwijl die maar 10% van zijn normale capaciteit geleverd heeft. Toch is de batterij niet leeg, de batterij kan enkel het gevraagd vermogen niet leveren. De alkaline batterij kan stroom leveren gedurende 3/4 uur, terwijl de saline batterij al uitgeput is na minder dan 10 minuten.
Batteriser
De spanning van saline en alkaline batterijen zakt als de batterij leeg geraakt. Dit is een eigenschap van alle zink-koolstof batterijen en is een goede graadmeter voor de resterende capaciteit.Een batterij wordt als leeg beschouwd als zijn spanning onder de 1.0V komt. Bepaalde toestellen stoppen echter met werken bij een hogere spanning. Sommige apparaten gebruiken slechts 20% van de scheikundige energie die in de batterij zit. Er blijft dus nog 80% energie over in de cel.
De Batteriser is een klein apparaatje dat over de batterijcontacten geschoven wordt en de spanning indien nodig opvoert tot 1.5V. Hier is geen nieuwe technologie voor nodig: het nieuws schuilt in het feit dat de omvormer zo klein gemaakt kon worden. De omvormer blijft werken tot de batterijspanning gezakt is tot 0.6V. Natuurlijk moet iedere batterij van een set met een dergelijke omvormer uitgerust worden.
Deze schakeling is natuurlijk vooral interessant voor toepassingen die echt 1.5V nodig hebben (bijvoorbeeld draadloze muizen). Taslampen (met gloeilamp) kunnen zonder probleem blijven werken op batterijen die bijna leeg zijn: de helderheid is gewoon wat lager.
Kathodische bescherming door zink electrode
Zink is een zeer electropositief metaal, daarom dat die ook in batterijen gebruikt wordt, samen met een electronegatief materiaal. Als geleidend (en betaalbaar) electronegatief materiaal hebben we enkel koolstof, waarbij een klemspanning van ongeveer 1.5V bereikt wordt. Koper is zeer goed geleidend, maar minder electronegatief en veel te duur om gebruikt te worden in batterijen. Deze combinatie werd gebruikt bij de zuil van Volta, waarbij de spanning per element 0.9V bedroeg.Bij cathodische bescherming gaat men een zinkblok opofferen om een stalen constructie te beschermen tegen het roesten. Bij grote constructies zoals schepen en pijpleidingen zal men meerdere zinkblokken gebruiken.
Langzamerhand wordt het zink weggevreten en als er nog 10% zink overblijft moet de electrode vervangen worden. De afbeeldingen rechts geven het oplossen van de zinkelectrode weer. De zinkelectrode wordt soms offerblok genoemd.
De kathodische bescherming wordt op schepen gebruikt om de stalen huid te beschermen, maar ook leidingen, reservoirs en andere constructies moeten beschermd worden.
Koperen installaties moeten beschermd worden door een ijzeren electrode (ijzer is goedkoper dan zink). Als men zink moet beschermen, dan zal men een nog meer electropositief metaal moeten gebruiken zoals aluminium en zelfs magnesium. Deze metalen worden eveneens gebruikt als de electrische geleidbaarheid slecht is (gezuiverd water, droge grond, enz).
De cathodische bescherming van schepen is belangrijk in de buurt van de schoeven die uit brons of messing bestaan. Dit zijn metalen die minder electropositief zijn dan staal en die dus een aantasting van het staal teweeg brengen. Het staal dient hier als beschermingselectrode voor het brons, wat hier natuurlijk ongewenst is: men moet meerdere zinkelectrodes in de buurt van de schroeven plaatsen om het aantasten van de staalhuid van het schip tegen te gaan.
Saline en alkaline batterij
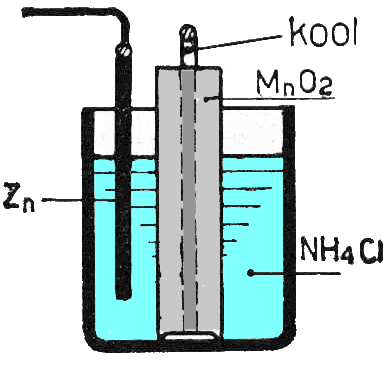
Lechlanché-cel

Fery batterij (eerste wereldoorlog)